通用名称: 磷酸西格列汀片
英文名称: JANUVIA (Sitagliptin Phosphate Tablets)
商品名称: 捷诺维
【成份】
磷酸西格列汀。
化学名称:7-[(3R)-3-氨基-1-氧-4-(2,4,5-三氟苯基)丁基]-5,6,7,8-四氢-3-(三氟甲基)-1,2,4-三唑酮[4,3-a]吡嗪磷酸盐(1:1)一水合物。
化学结构式:
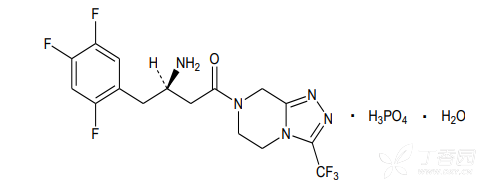
分子式:C16H15F6N5O•H3PO4•H2O
分子量:523.32
【适应症】
单药治疗
本品配合饮食控制和运动,用于改善2 型糖尿病患者的血糖控制。
与二甲双胍联用
当单独使用盐酸二甲双胍血糖控制不佳时,可与盐酸二甲双胍联合使用,在饮食和运动基础上改善 2 型糖尿病患者的血糖控制。
与胰岛素联用
本品配合饮食控制和运动,用于改善经一种磺脲类药物单药治疗或经一种磺脲类药物联合二甲双胍治疗后血糖控制不佳的 2 型糖尿病患者的血糖控制。
【超说明书适应症】
2型糖尿病的治疗联合用药:100 mg qd。
【用法用量】
本品单药或与二甲双胍联合治疗、或与磺脲类药物联合治疗(加用或不加用二甲双胍)或与胰岛素联合治疗(加用或不加用二甲双胍)的推荐剂量为 100 mg,每日一次。本品可与或不与食物同服。
当本品与一种磺脲类药物或胰岛素联合用药时,需考虑降低剂量磺脲类药物或胰岛素的剂量,以降低磺脲类药物或胰岛素导致的低血糖风险。(见注意事项,与一种磺脲类药物或胰岛素联合用药时的低血糖)
肾损害的患者
在开始本品治疗前应评估肾功能,并在开始治疗后应进行定期评估。
轻度肾损害患者(肾小球滤过率[egr ≥ 60 ml/min/1.73m2<90 ml/min1.73m2 服用本品时,不需要调整剂量。
中度肾损害的患者(eFR45 ml/min/1.73m2 且<60 ml/min/1.73m2)服用本品时,不需要调整剂量。
中度肾损害的患者(e30 ml/min/1.732 且<45 ml/min/1.73m 服用本品时,剂量调整为 50 mg,每日一次。
重度肾损害的患者(egfr ≥ 15 ml/min/1.7m2 且<30 ml/min/1.73m2)或终末期肾病(ESRD)患者(efr<15 ml/min/1.3m2)包括需要血液透析或腹膜透析的患者,服用本品时,剂量调整为 25 mg,每日一次,。服用本品不需要考虑透析的时间。
【禁忌】
对本品中任何成份过敏者禁用。(参见注意事项,超敏反应口不良反应,上市后经验。)
【注意事项】
概述
本品不得用于 1 型糖尿病患者或治疗糖尿病酮症酸中毒。
胰腺炎:有服用西格列汀的患者出现急性胰腺炎的报告,包括致命和非致命的出血性或坏死性胰腺炎(参见不良反应)患者应被告知急性胰腺炎的特征性症状:持续性的、重度腹痛。有报道提示停用西格列汀后胰腺炎症状消失。如果怀疑出现胰腺炎,则应停止使用西格列汀和其他可疑的药物。
心力衰竭:在其他两种 DPP4 抑制剂的心血管安全性研究中发现 DPP4 抑制剂治疗与心力衰竭之间的联系。这些研究评估了具有 2 型糖尿病和动脉粥样硬化性心血管疾病的患者。
在具有心力衰竭高风险的患者中,应在起始治疗前评估风险和获益,如既往有心力衰竭病史和肾功能损伤病史,治疗期间需观察患者的症状和体征。应告知患者心力衰竭的典型症状,在出现相应症状时马上向医生报告。如果发生心力衰竭,应根据当前的治疗标准进行评价处理,考虑停。
西格列汀心血管临床结果评估试验(TECOS 为一项在 14671 例 HbA1c ≥ 6.5 至 8.0% 且已患 CV 疾病的意向性治疗人群患者中开展的随机研究。在 3 年的中位随访后,相比于仅接受常规治疗而未接受西格列汀用药的 2 型糖尿病患者,在常规治疗的基础上补充西格列汀用药,未增加主要心血管不良事件的风险或因心力衰竭住院的风险。
肾损害患者用药:本品可通过肾脏排泄。为了使肾损害患者的本品血浆浓度与肾功能正常患者相似,在 eGFR<45m/min/1.73m2 的患者以及需要血液透析或腹膜透析的终末期肾病患者中,建议减少本品的剂量(参见用法用量,肾损害患者)。
与磺脲类药物或胰岛素联合治疗时的低血糖在本品单药治疗以及与一种已知不会导致低血糖的治疗药物(如:二甲双胍)联合用药的临床试验中,本品治疗组报告的低血糖发生率与安慰剂组相似与其它降糖药一样,当本品与胰岛素或一种磺脲类药物联合用药时,可观察到出现低血糖(参见不良反应)。因此,为了降低磺脲类药物或胰岛素导致的低血糖风险,可考虑采用较低剂量磺脲类药物或胰岛素(参见用法用量)。
超敏反应:本品上市后在患者的治疗过程中发现了以下严重超敏反应。这些反应包括过敏反应、血管性水肿和剥脱性皮肤损害,包括 Stevens-Johns-on 综合征。由于这些反应来自人数不定的人群自发性报告,因此通常不可能可靠地估计这些反应的发生率或确定这些不良反应与药物暴露之间的因果关系。这些反应发生在使用本品治疗的开始 3 个月内,有些报告发生在第一次服用之后。如怀疑发生超敏反应,停止使用本品,评估是否有其他潜在的原因,采用其他方案治疗糖尿病(参见禁忌和不良反应上市后经验部分)。
大疱性类天疱疮:据报告,随着 DPP-4 抑制剂的使用,上市后阶段已出现需要住院治疗的大疱性类天疱疮病例。在此类报告病例中,患者通常在局部外用或进行全身性免疫抑制治疗并停止 DPP-4 抑制剂用药后病情缓解。须告知患者在接受本品治疗的同时报告是否出现水疱或破溃。如果怀疑为大疱性类天疱疮,则应停止本品用药,并考虑转诊至皮肤科医生,以便进行诊断并适当治疗。
重度和失能性关节痛:已经有患者服用 DPP-4 制剂发生重度和失能性关节痛的上市后报告。药物起始治疗后至出现症状的时间间隔从一天到几年不等。病人在停药后症状得到缓解。部分患者在再次服用同一药物或其它 DPP-4 抑制剂治疗时症状复发。如果适当应考虑 P-4 抑制剂为引起重度关节疼痛的原因并停药。
大血管结局:目前尚无临床研究提供使用本品可降低大血管病变风险的确凿证据。
【孕妇及哺乳期妇女用药】
在胚胎器官形成期,大鼠和家兔口服给予西格列汀的剂量分别高达 250 mg/kg 和 125 mg/kg 时未产生畸形(按照成人每日推荐剂量 100 mg 计算,分别达人体暴露量的 32 倍和 22 倍)。
在大鼠口服给予剂量达每日 1000 mg/kg 时,观察到胚胎肋骨畸形(缺失、发育不全和波状肋骨)的发生率有轻度升高(按照成人每日推荐剂量 100 mg 计算,大约是人体暴露量的 100 倍)。
在大鼠口服给予剂量达每日 1000 mg/kg 时,观察到雄性和雌性后代断奶前平均体重有轻微降低,雄性后代断奶后体重增加。然而,动物生殖研究结果并不总是能够预测人体的反应情况。
目前没有在怀孕妇女中进行充分的和对照良好的研究;因此,本品在怀孕女性中使用的安全性未知。同其它口服抗高血糖药物一样,不建议在怀孕女性中使用本品。
西格列汀能够从哺乳期大鼠的乳汁中分泌。未知西格列汀能否在人类乳汁中分泌。因此,本品不宜应用于哺乳期女性。
【临床试验】
国外临床试验:
单药治疗
2 项临床研究评估了本品单药治疗的疗效和安全性。相比安慰剂,本品 100 mg,每日一次,能够显著改善患者的 HbA1c水平(在为期 18 周和为期 24 周的研究中,本品治疗组患者的 HbA1c水平的变化相比安慰剂分别为 0.60% 和 0.79%)、空腹血糖水平(FPG)和 2 小时餐后血糖水平(PPG)。在确诊糖尿病时间较短(小于 3 年)或基线 HbA1c水平较高的患者中,HbA1c水平的降低程度较大。
在为期 18 周和 24 周的临床研究中,对于研究入组时未接受抗高血糖药物治疗的患者,本品治疗组患者的 HbA1c水平与基线相比分别降低 0.67% 和 0.85%,安慰剂治疗组患者的 HbA1c水平与基线相比分别降低 0.10% 和 0.18%。
在这两项研究中,本品治疗组患者在第 3 周的空腹血糖水平与安慰剂治疗组相比显著下降(为期 18 周的研究,19.3 mg/dL;为期 24 周的研究,15.8 mg/dL),第 3 周是研究测定空腹血糖水平的第一个时间点。
本品每日 100 mg 治疗 2 型糖尿病患者能够显著改善β细胞功能,后者可通过若干指标进行评估,包括 HOMA-β(稳态模式评估法胰岛素分泌指数)、胰岛素原/胰岛素比值以及由频繁采样膳食糖耐量试验测定的β细胞反应性。
在接受本品治疗的患者中,低血糖的发生率与安慰剂组相似。在两项研究中,本品治疗组患者的体重与基线相比没有增加,而安慰剂组患者的体重与基线相比略有减轻。
在 2 型糖尿病合并慢性肾功能不全(肌酐清除率< 50 mL/min)患者参加的一项研究中,本品的安全性与耐受性和安慰剂基本相似。此外,与安慰剂相比,本品降低 HbA1C 水平和空腹血糖水平的程度与其它单药治疗临床研究的结果基本相似(参见药代动力学,特殊患者,肾功能不全)。
在二甲双胍基础上进行的添加联合治疗
总共有 701 例 2 型糖尿病患者参加了这项为期 24 周的随机、双盲、安慰剂对照试验,该试验的目的是评估本品与二甲双胍联合治疗的有效性。所有患者均是以二甲双胍单药治疗开始,并且剂量增加到至少 1500 mg/天。患者随机接受添加本品 100 mg 或安慰剂给药,每日一次。
与正在进行的二甲双胍治疗基础上添加安慰剂相比,在正在进行的二甲双胍治疗基础上加用西格列汀可以显著改善 HbA1c(-0.65%)、FPG (-25.4 mg/dL)和 2 小时 PPG (-50.6 mg/dL)。与安慰剂相比,HbA1c 的改善不受下列因素影响:基线 HbA1c、既往的抗糖尿病药物治疗、性别、年龄、基线体重指数、糖尿病诊断时间、存在代谢综合征或胰岛素抵抗(HOMA-IR)或胰岛素分泌的(HOMA-β)的标准参数。
与接受安慰剂的患者相比,接受本品治疗患者的总胆固醇、非 HDL 胆固醇和甘油三酯有轻微下降。在两个治疗组中,观察到体重有相似程度的下降。
西格列汀与二甲双胍联合治疗:活性药物对照研究
在一项为期 52 周的研究中,对使用二甲双胍单药治疗后血糖控制不良的患者增加 100 mg 西格列汀每日一次或格列吡嗪后的疗效和安全性进行比较。在降低 HbA1 方面,西格列汀与格列吡嗪疗效相当(在第 52 周,相对于基线平均变化值-0.67%;两组基线 HbA1C 约为.5% 格列吡嗪组患者的初始剂量为 5 mg/天,然后在接下来的 18 周内,研究者选择性调整剂量,从而达到目标 FPG<110 mg/dL,且未出现显著低血糖。允许用于优化血糖控制的最大剂量为 20 mg/天。对照组的格列吡嗪平均剂量为 10 mg/天,在整个研究期间,约 40% 患者所需的格列吡嗪剂量 5 mg/天。在这项研究中,西格列汀可改善胰岛素原/胰岛素比值(胰岛素合成和放行的效率标志物),而格列吡嗪可使之恶化。格列吡嗪组患者的体重相对于基线显著增加,而西格列汀患者的体重相对于基线显著下降(-1.5vs. + 1.1 kg)。
与格列美脲或格列美脲 + 二甲双胍联合治疗
在一项为期 24 周的安慰剂对照研究中,西格列汀 100 mg 每日一次作为添加疗法,与格列美脲或格列美脲加用二甲双胍联合治疗,可显著改善 HbA1c(与安慰剂组相比,组间差异分别为 0.57% 和-0.89% 和 FPG(与安慰剂组相比,分别为 19.3 mg/dl 和-20.7 mg/dL)。与安慰剂组患者相比,西格列汀组患者的体重小幅增加。
与胰岛素(加用或不如用二甲双胍联合治疗
在一项为期 24 周的安慰剂对照研究中,西格列汀 100 mg 每日一次作为添加疗法与稳定剂量胰岛素(加用或不加用二甲双胍联合治疗,可显著改善 HbA1c(与安慰剂组相比,组间差异 0.56%)fG(与安慰剂组相比,-15.0 mg/d)和 2 小时 PPG(与安慰剂组相比,-36.1 mg/d 西格列汀组和安慰剂组体重变化之间无显著差异。
另一项包括 660 例患者的 24 周安慰剂对照研究,目的是评价胰岛素疗法强化期间在甘精胰岛素中加入西格列汀(100 mg 每天一次)时,无论是否与二甲双胍(至少 1500 mg)联用,具有胰岛素节约效应的疗效和安全性。基线 HbA1 为 8.74%,基线胰岛素剂量为 371 天。指导患者根据指尖空腹血糖值对自己的甘精胰岛素剂量进行精细调整。第 24 周,西格列汀治疗组患者的日胰岛素剂量增幅为 19U/天,安慰剂组患者的日胰岛素剂量增幅为 241U/天。西格列汀和胰岛素(加用或不加用二甲双胍)治疗组患者中,HbA1C 降幅为-1.31%,安慰剂和胰岛素(加用或不加用二甲双胍治疗组患者中的对应降幅为-0.87%,相差-0.45%[95%C:-0.60,-0.29]。
【毒理研究】
重复/给药:
犬经口给`予西格列汀,每日 2、10 和 50 mg/kg,连续 53 周,试验中未见不良^反应剂量为 10 mg/kg,按照成人每日推荐剂量 100 mg 计算,上述剂量水平大约相当于人体暴露量的 6 倍。50 mg/kg 组的犬,出现了一过性与给药相关的体征,其中包括张口呼吸、流涎症、呕吐白色泡沫、共济失调、震颤、活动减少和/或弓背体态。在毒性试验第 14~27 周,50 mg/kg 组动物组织学检查结果提示轻度骨骼肌退化。
在毒性试验第 53 周未见发生骨骼肌退化,提示这一变化随着给药持续时间的延长没有重现或进展。每日剂量 50 mg/kg 的动物全身暴露量为人体暴露量的 26 倍。
遗传毒性:
西格列汀未显示遗传毒性。
生殖毒性:
在雄性和雌性大鼠交配前和交配过程中,西格列汀经口给予剂量达每日 1000 mg/kg/日(按照成人每日推荐剂量 100 mg 计算,大约相当于人体暴露量的 100 倍),未见药物对生育力存在不良作用。大鼠经口给药剂量达 1000 mg/kg/日时,观察到与给药相关的胚胎肋骨畸形(缺失、发育不全和波状肋骨)发生率轻度升高。
大鼠在给予西格列汀 250 mg/kg/日(按照成人每日推荐剂量 100 mg 计算,大约相当于是人体暴露量的 32 倍)、兔在给予 125 mg/kg/日(按照成人每日推荐剂量 100 mg 计算,大约相当于是人体暴露量的 22 倍)时未见致畸作用。西格列汀可通过哺乳大鼠的乳汁分泌。
致癌性:
小鼠 2 年经口给予西格列汀 500 mg/kg 时,未见肿瘤发生率增加。大鼠 2 年经口给予西格列汀,剂量为 50、150 和 500 mg/kg/日,在 500 mg/kg/日组雄性大鼠中,可见肝腺瘤和肝癌发病率增加;在 500 mg/kg/日组雌性大鼠中,可见肝癌发病率增加。
500 mg/kg/日组按照成人每日推荐剂量 100 mg 计算,大约相当于人体暴露量的 58 倍,此剂量下可见大鼠肝毒性。西格列汀未观察到诱发肝肿瘤作用的剂量为每日 150 mg/kg/日(按照成人每日推荐剂量 100 mg 计算,大约相当于人体暴露量的 19 倍)。
由于已经发现药物的肝毒性与诱发大鼠肝肿瘤相关,因此大鼠肝肿瘤发生率的增高可能是继发于高剂量药物的慢性肝脏毒性作用。这一发现对人类临床使用的意义不明。
【药理作用】
药理/作用
西格列汀`二肽基肽酶 4(DPP-4)抑制剂,肠胰岛激素包括胰高糖^素样多肽-1(lP-1)和葡萄糖依赖性促胰岛素分泌多肽 GP),由肠道全天释放,并且在进餐后水平升高。肠促胰岛激素是参与葡萄糖内环境稳态生理学调控的内源性系统的一部分。当血糖浓度正常或升高时,gLP-1 和 GP 可通过涉及环磷腺苷的细胞内信号途径增加胰腺β细胞合成并释放胰岛素。此外,gLP-1 还可以抑制胰腺 a 细胞分泌胰高糖素。胰高糖素浓度的降低和胰岛素水平的升高可降低肝葡萄糖生成,从而降低血糖水平 GLP-1 和 GP 的作用具有葡萄糖依赖性,当血糖浓度较低时,GLP1 不会促进胰岛素释放,也不会抑制胰高糖素分泌。当葡萄糖水平高于正常浓度时,GLP-1 和 GP 促进胰岛素释放的作用增强。此外,GLP-1 不会损伤机体对低血糖的正常胰高糖素释放反应。GLP-1 和 GP 的活性受到 DPP-4 酶的限制,后者可以快速水解肠促胰岛激素,产生非活性产物。西格列汀能够防止 DPP-4 水解肠促胰岛激素,从而增加活性形式的 GLP-1 和 GP 的血浆浓度。通过增加活性肠促胰岛激素水平,西格列汀能够以葡萄糖依赖的方式增加胰岛素释放并降低胰高糖素水平。
【药代动力学】
对西/格列汀药代动`力学特征的研究已经在健康受试者和 2 型糖^尿病患者中广泛地进行。健康受试者口服给药 100 mg 剂量后,西格列汀吸收迅速,服药 1 至 4 小时后血浆药物浓度达峰值 (Tmax中值) 。
西格列汀的血药 AUC 与剂量成比例增加。健康志愿者单剂量口服 100 mg 后,西格列汀的平均血药 AUC 为 8.52u M·hr,Cmax为 950 nM,表观终末半衰期(tl/2)为 12.4 小时。服用西格列汀 100 mg 达到稳态时的血浆 AUC 与初次给药相比增加约 14%。个体自身和个体间西格列汀 AUC 的变异系数较小 (5.8% 和 15.1%) 。西格列汀在健康受试者和 2 型糖尿病患者中的药代动力学指标大体相似。
吸收
西格列汀的绝对生物利用度大约为 87%。因为本品和高脂肪餐同时服用对药代动力学没有影响,本品可以与或不与食物同服。
分布
健康受试者单剂静脉注射西格列汀 100 mg 平均稳态分布容积大约为 198 公升。西格列汀可逆结合血浆蛋白的结合率较低(38%)。
代谢
西格列汀主要以原型从尿中排泄,代谢仅是次要的途径。大约 7 g% 西格列汀是以原型从尿中排泄的。
口服[14C]标记的西格列汀后,从西格列汀的代谢产物中检测到大约 16% 的放射活性。检测到 6 种微量的代谢产物,且对于西格列汀抑制血浆 DPP-4 的活性没有作用。体外试验证实了参与西格列汀少量代谢过程的主要酶是 CYP3A4,及 CYP2C8。
排泄
健康受试者口服[14C]标记的西格列汀一周内,由粪便(13%)或由尿(87%)中检测出的放射性活性约 100%。西格列汀口服给药 100 mg 表观终末半衰期 tl/2 大约为 12.4 小时,肾清除率大约为 350 mL/min。
西格列汀的排泄主要通过肾脏清除和肾小管的主动分泌。西格列汀是人类有机阳离子转运子-3 (hOAT-3) 的作用底物,hOAT-3 可能参与肾脏对西格列汀清除。hOAT-3 与西格列汀转运的临床相关性未明。西格列汀也是一种 p-糖蛋白的作用底物,p-糖蛋白可能也参与介导了肾脏对西格列汀的清除。然而,p-糖蛋白的抑制剂环孢霉素,并不会减少西格列汀的肾脏清除。
特殊患者
肾功能不全:
项单剂量、开放性的研究评估了本品 50 mg 在不同程度慢性肾功能不全患者中的药代动力学,并与正常健康对照受试者比较。本研究包括的肾功能不全患者按照不同的肌酐清除率水平分为轻度 (50 至低于 80 mL/min) 、中度 (30 至低于 50 mL/min) 和重度 (低于 30 mL/min) ,重度还包括终末期肾病(ESRD)进行血液透析治疗的患者。
肌酐清除率通过测量 24 小时尿肌酐清除值计算或通过血清肌酐水平应用 Cockcroft-Gault 公式估计:

轻度肾功能不全的患者与对照的正常健康受试者相比,对西格列汀的血浆浓度影响没有临床意义。与对照的正常健康受试者相比,观察到中度肾功能不全的患者西格列汀血浆 AUC 大约增加 2 倍;重度肾功能不全和终末期肾病正在进行透析的患者,观察到西格列汀血浆 AUC 大约增加 4 倍。
西格列汀可以少量被透析清除 (用药后 4 小时开始透析,透析时间为 3 至 4 小时,大约 13.5% 被透析清除) 。为了达到与正常肾功能患者相似的血浆浓度,建议对中、重度和终末期肾病需要透析的患者降低药物剂量。 (见用法用量, “肾功能不全患者”部分)
肝功能不全:
与作为对照的健康受试者相比,中度肝功能不全的患者 (Child-Pugh 积分 7 至 9) 单剂服用本品 100 mg 后,西格列汀平均 AUC 和 Cmax分别增加约 21% 和 13%。这些差异没有临床意义。对于轻度或中度肝功能不全的患者,不需要对本品进行剂量调整。
目前尚没有严重肝功能不全患者 (Child-Pugh 积分 > 9) 的临床用药经验。然而,由于西格列汀主要通过肾清除,预计严重肝功能不全不会对西格列汀的药代动力学产生影响。
老年患者:
无需根据年龄调整剂量。依据对Ⅰ期和Ⅱ期的人群药代动力学数据分析的结果,年龄未对西格列汀的药代动力学产生有临床意义的影响。与年轻受试者相比,老年受试者 (65 岁至 80 岁) 的西格列汀血浆浓度大约高 19%。
儿童:
本品未在儿童患者中进行临床研究。
性别:
无需根据性别调整剂量。依据对Ⅰ期药代动力学数据和Ⅰ期期人群药代动力学数据分析的结果,性别未对西格列汀药代动力学产生有临床意义的影响。
种族:
无需根据种族调整剂量。依据对包括白种人、西班牙裔人、黑人、亚洲人和其他种族人群受试者的 I 期药代动力学数据和Ⅰ期Ⅱ期人群药代动力学数据的分析结果,种族未对西格列汀的药代动力学产生有临床意义的影响。
体重指数(BMI):
无需根据体重指数调整剂量。依据对Ⅰ期药代动力学数据和Ⅰ期Ⅱ期人群药代动力学数据的分析结果,体重指数未对西格列汀的药代动力学产生有临床意义的影响。
2 型糖尿病:2 型糖尿病患者西格列汀药代动力学的结果与健康受试者基本相似。
【是否OTC】
否