请仔细阅读说明书并在医生的指导下使用
通用名称: 左乙拉西坦片
英文名称: Keppra (Levetiracetam Tablets)
商品名称: 开浦兰
【成份】
本品的活性成份为左乙拉西坦,其化学名称为(S)-α-乙基-2-氧代-1-吡咯烷乙酰胺
化学结构式:
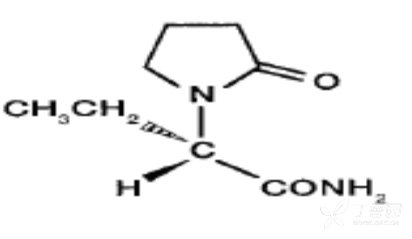
分子式:C8H14N2O2
分子量:170.21
【适应症】
用于成人及 4 岁以上儿童癫痫患者部分性发作(伴或不伴继发性全面性发作)的治疗。
用于成人及 16 岁以上青少年癫痫患者全面性强直阵挛发作的加用治疗。
【用法用量】
(1)给药途径: 口服。需以适量的水吞服,服用不受进食影响。
(2)给药方法和剂量:
成人( ≥ 18 岁)和青少年(12 岁~17 岁)体重 ≥ 50 kg
起始治疗剂量为每次 500 mg,每日 2 次。
根据临床效果及耐受性,每日剂量可增加至每次 1500 mg,每日 2 次。剂量的变化应每 2~4 周增加或减少 500 mg/次,每日 2 次。
老年人( ≥ 65 岁)
根据肾功能状况,调整剂量(详见下文有关肾功能受损病人描述)。
4~11 岁的儿童和青少年(12~17 岁)体重 ≤ 50 kg
起始治疗剂量是 10 mg/kg,每日 2 次。
根据临床效果及耐受性,剂量可以增加至 30 mg/kg,每日 2 次。剂量变化应以每两周增加或减少 10 mg/kg,每日 2 次。应尽量使用最低有效剂量。
儿童和青少年体重 ≥ 50 kg,剂量和成人一致。
医生根据患者的体重、年龄和所需剂量,可推荐患者使用相应合适的剂型和规格。
青少年和儿童推荐剂量
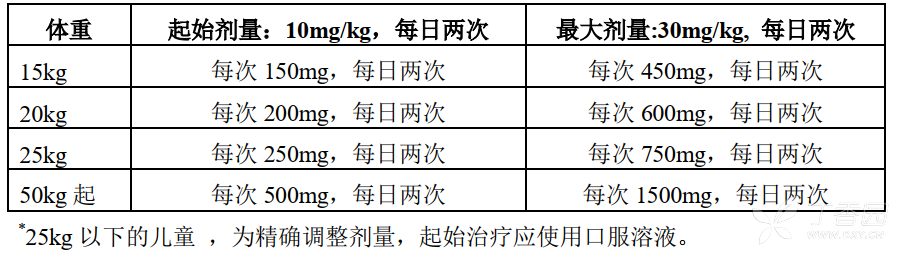
婴儿和小于 4 岁的儿童患者
目前尚无相关的充足的资料。
肾功能受损的病人
成人肾功能受损病人,根据肾功能状况,按表中不同肌苷清除率(CLcr)ml/min(测出血清肌苷值按下述计算方法)调整日剂量。

CLcr 根据人体体表面积 BSA 进行调整:

肾功能受损病人的剂量

儿童肾功能损害病人应根据肾功能状态调整剂量,因为左乙拉西坦的清除与肾功能有关。这基于成人肾功能损害患者的一项研究。
肌酐清除率 CLcr(ml/min/1.73m2)通过检测血清中肌酐(mg/dl)值估计,青少年和儿童患者的肌酐清除率可由下述公式获得:

ks=0.45(足月婴儿至 1 岁);
ks=0.55(13 岁以下儿童和女性青少年);
ks=0.7(男性青少年)
针对儿童和体重<50 kg 的青少年患者的肾功能损害状况进行剂量调整。
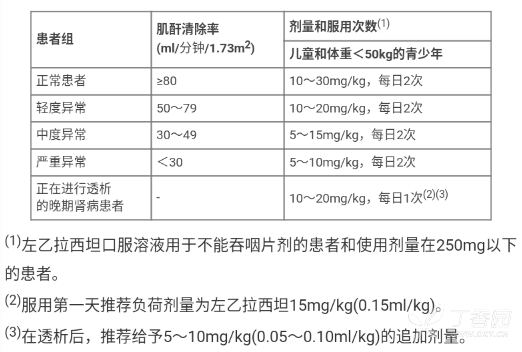
肝病患者
对于轻度和中度肝功能受损的病人,无需调整给药剂量。严重肝损的病人,肌苷清除率可能低估肾功能不全的程度,所以,如果病人的肌苷清除率小于 60 ml/min/1.73m2,日剂量应减半。
【禁忌】
对左乙拉西坦过敏或者对吡咯烷酮衍生物或者其他任何成分过敏的病人禁用。
【注意事项】
停药
根据当前的临床实践, 如需停止服用本品, 建议逐渐停药。(例如:成人和体重 50 kg 或以上的青少年每隔 2~4 周, 每次减少 500 mg, 每日 2 次;体重<50 kg 的儿童和青少年应每隔 2 周,每次减少 10 mg/kg,每日 2 次)。
血细胞计数
左乙拉西坦给药后,曾被描述过与之有关的血细胞计数下降(中性粒细胞减少、粒细胞缺乏、白细胞减少、血小板减少和全血细胞减少)。建议出现明显无力、发热、反复感染或凝血障碍的患者接受全血细胞计数的检测。
肾功能不全
对于肾功能损害的患者左乙拉西坦的服用剂量需要调整,对于严重肝功能损害,在选择服用剂量之前,需进行肾功能检测,患者的服用剂量需参照【用法与用量】。
自杀
曾有关于服用抗癫痫药物包括左乙拉西坦治疗的癫痫患者出现自杀,自杀未遂、自杀意念和行为的报道。基于随机安慰剂对照的抗癫痫药物临床研究进行的荟萃分析显示了自杀意念及其行为风险的轻度增加。关于该风险增加的机制尚属未知。
因此,应该监测患者是否出现抑郁和/或有自杀意念的症状及行为,并给予合适的处理。如果出现抑郁和/或自杀意念的症状及行为时,患者(及患者的护理人)应寻求医疗帮助。
儿科人群
在现有的儿童临床研究资料中未显示对儿童的成长和青春期有影响。然而,在认知、智力、成长、内分泌功能、青春期和生育潜力的长期影响仍未知。
对驾驶和应用机器影响
目前没有研究关于服药后对机器驾驭能力和驾驶车辆能力的影响。
因为个体敏感性差异,在治疗初始阶段或者剂量增加后,会产生嗜睡或者其他中枢神经症状。因而,对于这些需要服用药物的病人不推荐操作需要技巧的机器,如驾驶汽车或者,操纵机械。
【孕妇及哺乳期妇女用药】
数项前瞻性妊娠登记的上市后数据记录了在妊娠的前三个月中暴露在左乙拉西坦单药治疗的超过 1000 名妇女的结果。总体而言,这些数据未提示严重先天畸形风险显著增加,但是不能完全排除致畸风险。使用多种抗癫痫药物治疗伴随的先天畸形的风险比单药治疗高。动物试验证明该药有一定的生殖毒性。对于人类潜在的危险目前尚不明确。如非临床必需,孕妇请勿应用左乙拉西坦。 与其他抗癫痫药物类似,妊娠期间的生理变化会影响左乙拉西坦的浓度。怀孕期间左乙拉西坦浓度降低已有报道。在妊娠晚期,左乙拉西坦浓度的降低更明显(最高降幅为妊娠前基线浓度的 60%)。中断抗癫痫治疗, 可能使病情恶化, 对母亲和胎儿同样有害。
动物试验表明左乙拉西坦可以从乳汁中排出,所以,不建议病人在服药同时哺乳。若哺乳期内必须服用左乙拉西坦治疗,则需权衡该治疗的利益/风险与哺乳的重要性。
生育能力
动物研究表明本品对生育能力无影响。但尚无临床研究资料,对人类生育能力的潜在风险不详。
【临床试验】
临床研究
部分性发作的加用治疗
对难治性癫痫部分性发作病人(伴或不伴有继发性全身发作)进行的 3 个多中心、随机、双盲和安慰剂对照的临床研究,建立了成年人左乙拉西坦作为加用治疗(其他抗癫痫药物的辅助治疗)的有效性数据。进入研究 1 或研究 2 的病人患有至少 2 年的难治性癫痫部分性发作,并服用 2 种以上传统抗癫痫药。进入研究 3 的病人患有至少 1 年的难治性癫痫部分性发作,并服用 1 种传统抗癫痫药。在试验时,病人正服用至少 1 个最多 2 个抗癫痫药的稳定的给药方案。在基线阶段,每个 4 周的阶段病人必须至少发生 2 次部分性发作。
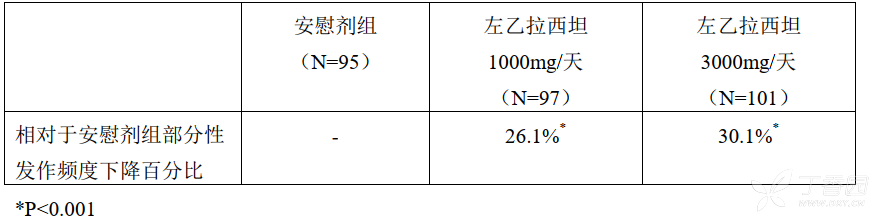
临床研究 1
临床研究 1 是在美国 41 个研究地点进行的双盲、安慰剂对照的平行试验,在一个 12 周基线阶段后,病人随机分配入左乙拉西坦剂量 1000 mg/天(N = 97)、左乙拉西坦 3000 mg/天(N = 101)和安慰剂(N = 95)组每日分 2 次给药。进行 18 周的治疗周期内(6 周的逐量加药期 + 12 周的固定剂量评价期)的疗效评估,试验期间可同服抗癫痫药治疗方案保持不变。主要的疗效指标指在整个随机治疗阶段(逐量加药阶段 + 评价阶段)相对于安慰剂组每周部分性发作频度下降百分比的组间比较。次要的疗效指标包括有效应答率(部分性发作频度相比基线下降 ≥ 50% 的发生率)。结果显示:左乙拉西坦治疗组每周部分性发作频度有明显地减少。整个随机治疗阶段左乙拉西坦治疗组的有效应答率明显高于安慰剂组,并呈剂量相关性。拉西坦治疗组的有效应答率明显高于安慰剂组,并呈剂量相关性。
临床研究 2
临床研究 2 是在欧洲 62 个研究中心进行的双盲、安慰剂对照的交叉试验,设计试验的第 1 阶段(阶段 A)作为平行组试验来分析,在 12 周的基线阶段后,病人随机分配入左乙拉西坦 1000 mg/天(N = 106)、左乙拉西坦 2000 mg/天(N = 105)和安慰剂(N = 111)组,每日分 2 次给药。进行了 16 周的治疗周期(含 4 周的逐量加药期和 12 周的稳定剂量评价阶段)的疗效评估,在试验期间同服抗癫痫药的治疗方案保持不变。主要的疗效指标在整个随机治疗阶段(逐量加药期 + 评价阶段)相对于安慰剂组每周部分性发作频度下降百分比的组间比较,次要的疗效指标包括有效应答率(部分性发作频度下降 ≥ 50% 的病人发生率)。结果显示:左乙拉西坦治疗组每周部分性发作频度有明显地减少。整个随机治疗阶段左乙拉西坦治疗组的有效应答率明显高于安慰剂组,并呈剂量相关性。左乙拉西坦 2000 mg/天对左乙拉西坦 1000 mg/天有效应答率的比较具统计显著性(P = 0.02),和交叉试验的分析产生了相似的结果。
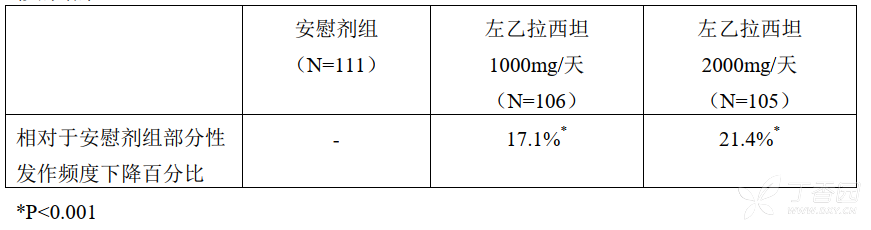
临床研究 3
临床研究 3 是在欧洲 47 个研究中心进行的双盲、安慰剂对照的平行组试验,该研究比较了对伴有或不伴有继发性全身发作的难治性癫痫部分性发作病人,仅同服一种抗癫痫药治疗,12 周的基线阶段后,病人随机分配入的上述 2 个治疗组中的一个。16 周的治疗周期由一个 4 周的逐量加药阶段,在 12 周的稳定剂量阶段进行了疗效的评估。主要的疗效指标在整个治疗阶段(逐量加药期 + 评价阶段)相对于安慰剂组每周部分性发作频度下降百分比的组间比较,次要的疗效指标包括有效应答率(部分性发作频度相比基线下降 ≥ 50% 的发生率)。结果显示:左乙拉西坦治疗组每周部分性发作频度有明显地减少。整个治疗阶段左乙拉西坦治疗组的有效应答率明显高于安慰剂组。

儿童癫痫病人部分性发作的有效性研究
北美 60 个试验中心对 4 至 16 岁难治性癫痫部分性发作的儿童进行多中心、随机、双盲和安慰剂对照的临床研究,建立了在儿童患者中左乙拉西坦作为加用治疗(其他抗癫痫药物的辅助治疗)的有效性数据。患儿在筛选前 4 周内至少有 4 次发作,在 8 周基线期内(每个 4 周的基线期内都至少有 4 次发作),同时服用 1~2 种稳定剂量的抗癫痫药。共有 198 名患儿随机分配入(左乙拉西坦组 N = 101 和安慰剂组 N = 97)。左乙拉西坦起始剂量为 20 mg/kg/天,分两次给药,在治疗期间,以每 2 周 20 mg/kg/天的增量进行调整,增至目标剂量 60 mg/kg/天。本临床研究含 8 周的基线期、4 周逐量加药期,以及 10 周的评价期。主要的疗效指标指在整个随机治疗阶段(逐量加药阶段 + 评价阶段)相对于安慰剂组每周部分性发作频度下降百分比的组间比较。次要的疗效指标包括有效应答率(部分性癫痫发作频度相比基线下降 ≥ 50% 的发生率)结果显示:左乙拉西坦治疗组每周部分性发作频度有明显地减少。整个随机治疗阶段左乙拉西坦治疗组的有效应答率明显高于安慰剂组。

中国的临床研究
在中国六个中心(上海、北京、重庆、成都)对左乙拉西坦口服 16 周作为添加治疗对于成人及 16 岁以上青少年癫痫部分性发作的疗效与安全性进行了多中心、随机、双盲平行、安慰剂对照的临床研究,两个治疗组分别为安慰剂组和左乙拉西坦组日剂量为 3000 mg。16 周的临床试验共筛选了 224 例患者,最终 189 例完成了试验(左乙拉西坦组 98 例,安慰剂组 91 例)。所有受试者均为中国人,男女比例分别 52% 和 48%。两治疗组人口统计学资料和其他基线特征具有可比性,基线期的每周癫痫发作频率也相似,(左乙拉西坦组为 1.81 次/周,安慰剂组 1.75 次/周)。
主要疗效指标为 16 周治疗期间(4 周增量期 + 12 周维持治疗期)每周癫痫部分性发作(I 型)频率。16 周试验结束时研究者采用整体临床疗效评估表对受试者整体疗效进行了评价。
意向治疗人群分析结果表明,16 周治疗期内左乙拉西坦组每周癫痫部分性发作频率较安慰剂组明显下降(p<0.001),疗效明显优于安慰剂,其相对安慰剂组减少百分数为 26.8%(95%可信区间:14.0%~37.7%)。方案治疗人群结果类似。
16 周治疗期内,左乙拉西坦组的癫痫部分性发作 50%有效率的比例为 57/102(55.9%),明显高于安慰剂组的 26/100(26.0%)。相对安慰剂的 OR 值为 3.6(95%可信区间:2.0~6.5),(p<0.001)。左乙拉西坦组中有 11 例(10.8%)未发生任何癫痫部分性发作,明显高于安慰剂组(2 例,2.0%)(p<0.001)。
本研究安全性评估结果显示安慰剂组和左乙拉西坦组是有可比性的。左乙拉西坦组最常报导的不良事件是嗜睡(18 个受试者,17.5%),其次是血小板降低。
疗效/药代动力学/药效学研究结果
意向治疗(ITT)人群癫痫部分性发作次数频率分析
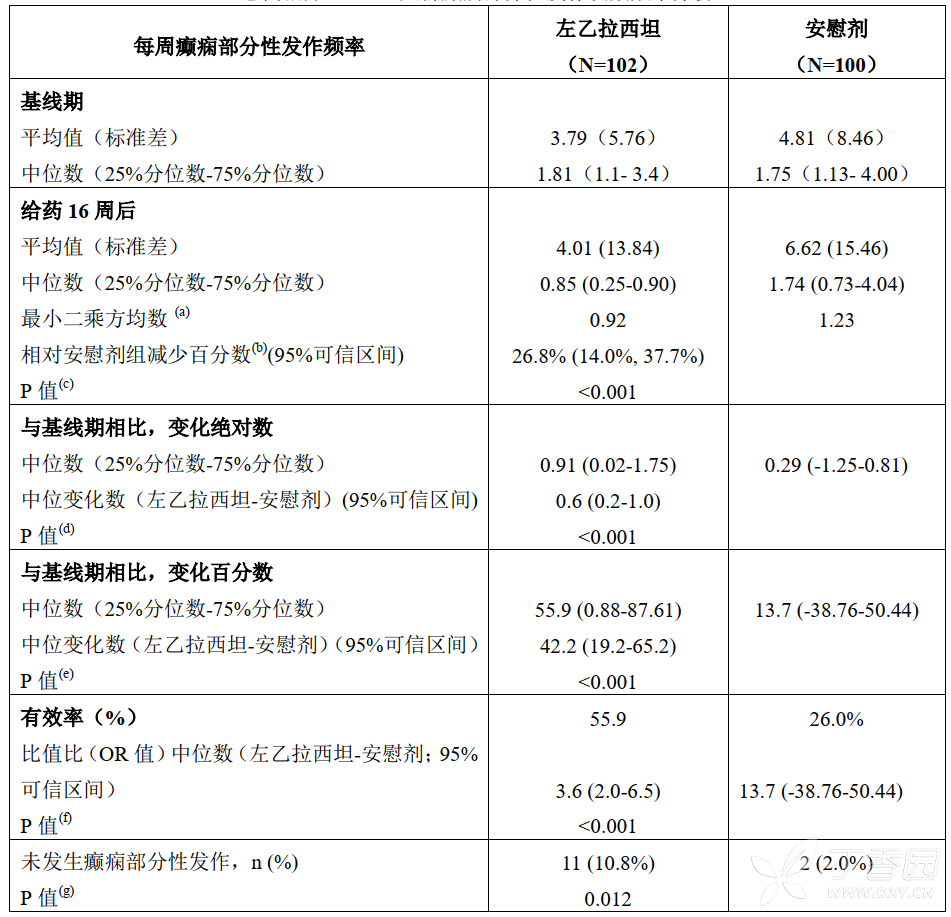
(a)将每周癫痫部分性发作的频率经自然对数转换[Ln(1 + X)]后,采用协方差模型进行分析,以基线值为协变量,以研究中心和治疗组为固定变量进行估计。
(b)相对安慰剂组减少百分数采用以下公式进行计算:100 × [1-Exp (LSM 左乙拉西坦–LSM 安慰剂)]。
(c)与安慰剂进行比较。
(d)采用 WILCOXON 秩和检验
(e)采用 WILCOXON 秩和检验。
(f)采用 Logistic 回归分析。
(g)采用 CMH 以中心分层分析。
总的来说,左乙拉西坦作为加药疗法治疗成年人及 16 岁以上青少年癫痫部分性发作,16 周治疗期内可以显著减少癫痫每周发作频率,安全耐受性较好。
全面性强直阵挛发作的加用治疗
III 期中国和日本国际性研究
一项 III 期中国-日本国际多中心、随机、双盲、安慰剂对照、平行组研究入选了全面性强直阵挛发作的成人癫痫患者( ≥ 16 岁)。患者随机接受左乙拉西坦(成人的目标日剂量为 1000 mg 和 3000 mg)或安慰剂治疗。
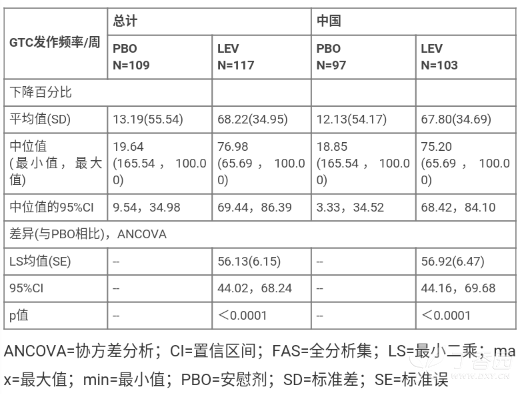
共有 251 例控制不良的全面性强直阵挛发作的 16 岁及以上癫痫受试者口服左乙拉西坦 1000 或 3000 mg/天或安慰剂治疗,与其他抗癫痫药物联用,持续 28 周。如果受试者在服用左乙拉西坦 1000 mg/天时出现癫痫发作,剂量将上调至 3000 mg/天。主要终点为每周全面强直阵挛发作频率与基线相比的下降百分比,结果如下表所示。与安慰剂组患者相比,LEV 治疗组的全面性强直阵挛发作频率与基线相比的下降幅度具有统计学意义(p<0.0001,协方差分析,以治疗组合国家作为效应因素,基线时每周的全面性强直阵挛发作频率作为协变量)。此外,各组的 50% 应答者比例(每周的全面性强直阵挛发作频率与基线相比下降 50% 或以上的受试者百分比)分别为:安慰剂组为 28.4%(31/109 例受试者),LEV 组为 77.8%(91/117 例受试者)。
在中国受试者中,与安慰剂组患者相比,LEV 治疗组患者的全面性强直阵挛发作频率与基线相比的下降幅度具有统计学意义(p<0.0001)。各组的 50% 应答者比例:安慰剂组为 27.8%(27/97 例受试者),LEV 组为 76.7%(79/103 例受试者)。
中国受试者的有效性结果与总人群的有效性结果相似。
【毒理研究】
遗/传`毒性
左乙拉^西坦 Ames 试验、CHO/HGPRT 位点基因座哺乳动物细胞基因突变试验、CHO 细胞染色体畸变试验、小鼠微核试验结果均为阴性。左乙拉-西坦水解产物和人体主要代谢物(ucb L057)在 Ames 试验、小鼠淋巴瘤试验结果均为阴性。
生殖毒性
在剂量高达 1800 mg/kg/天[以 mg/m2或暴露量(AUC)推算相当于人最高推荐剂量(MRHD)3000 mg 的 6 倍]时,未见对雄性或雌性大鼠生育力或生殖行为的不良影响。
在动物试验中,左乙拉西坦在相似于或高于人体治疗剂量时可产生发育毒性。妊娠大鼠在器官形成期给药,剂量为 3600 mg/kg/天(以 mg/m2推算相当于 MRHD12 倍)时,可见胎仔体重降低和胎仔骨骼变异发生率增加。发育毒性的无影响剂量为 1200 mg/kg/天,该试验中未见母体毒性。妊娠家兔在器官形成期给药,剂量为 ≥ 600 mg/kg/天(以 mg/m2推算相当于 MRHD 的 4 倍)时,可见胚胎-胎仔死亡率增加和胎仔骨骼异常发生率增加;在剂量为 1800 mg/kg/天(按 mg/m2推算相当于 MRHD 的 12 倍)时,可见胎仔体重降低,胎仔畸形发生率增加,并可见母体毒性。发育毒性的无影响剂量为 200 mg/kg/天。
雌性大鼠在妊娠和哺乳期间给药,在剂量为 ≥ 350 mg/kg/天(按 mg/m2 推算相当于 MRHD)时,可见胎仔骨骼异常、出生前和/或出生后生长迟滞;在剂量为 1800 mg/kg/天(按 mg/m2推算相当于 MRHD 的 6 倍)时,可见幼仔死亡率增加和子代行为异常;该试验中发育毒性的无影响剂量为 70 mg/kg/天,未见明显的母体毒性。大鼠在妊娠第 3 期和整个哺乳期给药,剂量至 1800 mg/kg/天(按 mg/m2推算相当于 MRHD 的 6 倍),未见对发育和母体的不良影响。
致癌性
大鼠掺食法给予左乙拉西坦 104 周,剂量为 50、300 和 1800 mg/kg/天(高剂量按 mg/m2或暴露量推算相当于 MRHD 的 6 倍),未见致癌性。小鼠掺食法中给予左乙拉西坦 80 周,剂量为 60、240 和 960 mg/kg/天(高剂量按 mg/m2 或暴露量推算相当于 MRHD 的 2 倍),未见致癌性。但由于给药剂量较低,未能充分评估对该动物种属的潜在致癌性。
幼龄动物毒性
幼龄大鼠(4~52 日龄给药)和幼龄犬(3~7 周龄给药)给药剂量达到 1800 mg/kg/日[以 mg/m2计算,分别相当于 4~11 岁儿童和 12~17 岁青少年(体重 ≤ 50 kg)最大推荐剂量 60 mg/kg/天的 7 倍和 24 倍],未发现潜在的年龄特异性毒性。
【药理作用】
左/乙`拉西坦是吡^咯烷酮衍生物。左乙拉西坦抗癫痫作用的确切机制尚不清楚。在多种癫痫动物模型中评估了左乙拉西坦的抗-癫痫作用。左乙拉西坦对电流或多种致惊厥剂最大刺激诱导的单纯癫痫发作无抑制作用,并在亚最大刺激和阈值试验中仅显示微弱活性。但对毛果芸香碱和红藻氨酸诱导的局灶性发作继发的全身性发作观察到保护作用,这两种化学致惊厥剂能模拟一些伴有继发性全身发作的人复杂部分发作的特征。左乙拉西坦对复杂部分发作的大鼠点燃模型的点燃过程和点燃状态均具有抑制作用。这些动物模型对人体特定类型癫痫的预测价值尚不明确。
体外、体内试验显示,左乙拉西坦可抑制海马癫痫样突发放电,而对正常的神经元兴奋性无影响,提示左乙拉西坦可能选择性地抑制癫痫样突发放电超同步化和癫痫发作的传播。
左乙拉西坦在浓度高至 10μM 时,对多种已知受体(如苯二氮卓类、GABA、甘氨酸、NMDA)、再摄取位点和第二信使系统无亲和力。体外试验显示左乙拉西坦对神经元电压门控的钠离子通道或 T-型钙电流无影响,不直接易化 GABA 能神经传递,但体外研究显示左乙拉西坦可对抗 GABA 激活电 16 流和甘氨酸门控电流的负向调节因子的活性,并可部分抑制神经元细胞的 N-型钙电流。
在大鼠脑组织中发现了左乙拉西坦的可饱和和立体选择性的神经元结合位点,试验显示该特异性结合位点是突触囊泡蛋白 SV2A,该蛋白被认为参与囊泡递质外排(出胞)。虽然左乙拉西坦结合 SV2A 的分子学意义尚不清楚,但是在听源性癫痫小鼠模型中,左乙拉西坦及其相关类似物与 SV2A 的亲和力存在强弱次序,该亲和力强弱与抗发作活性相关。这提示左乙拉西坦与$V2A 蛋白的相互作用可能与其抗癫痫作用机制有关。
【药代动力学】
左/乙`拉西坦是极^易于溶解和具有高度渗透性的化合物。呈线性代谢,个体内和个体间差异小。多次给药,不影响其清除率。本品没-有性别、种族差异性和生理周期变异。本品的药代动力学研究显示健康志愿者和病人的药代动力学数据具有可比性。
由于左乙拉西坦的吸收完全性和线性关系,其血药浓度可以根据口服剂量 mg/kg 进行预测,因而没有必要对左乙拉西坦进行血药浓度的监控。
成人及儿童患者的唾液和血药浓度显示有显著的相关性(服用本品片剂或本品液体制剂 4 小时后,唾液/血液药物浓度比是 1 到 1.7)。
成人和青少年
吸收
左乙拉西坦经口服后迅速吸收,口服绝对生物利用度接近 100%。给药 1.3 小时后,血药浓度达峰,如果每日给药 2 次,2 天后达到稳态坪浓度,如果单剂量为 1000 mg 及 1000 mg 每日两次,典型的峰浓度为 31 和 43 μg/ml。吸收时间与剂量无关,摄取食物不影响吸收程度。
分布
目前没有人体组织分布的数据。无论是左乙拉西坦还是其主要代谢产物均不易与血浆蛋白结合(<10%)。分布容积为 0.5-0.7 L/kg,接近人体水容积。
生物转运
左乙拉西坦在人体内并不广泛分解,主要代谢途径是通过水解酶的乙酰胺化(给药剂量的 24%)。主要代谢产物 UCB L057,并不由肝色素 P450 转运体系转化而来。体内大部分组织包括血细胞均可测定乙酰胺基团水解物。代谢产物 UCB L057 无药理活性。
2 个少量代谢途径也已经确定,一个是羟化吡咯烷途径(给药剂量的 1.6%),另外是吡咯烷基团开环,大约占剂量的 0.9%。
其他不能够确定的代谢途径的代谢产物占给药剂量的 0.6%。
目前体外试验数据表明无论是左乙拉西坦还是其主要代谢物均无手性翻转。
体外试验数据表明左乙拉西坦和其主要代谢产物并不抑制肝色素 P450 异构(CYP3A4,2A6,2X8/9/10, 2C19, 2D6, 2E1 和 1A2)葡萄糖醛转移酶(UGT1* 6,UGT1*1 和 UGT[pl6.2])和环氧化物羟基酶活性。此外,左乙拉西坦在体外试验表明不影响丙戊酸的葡萄糖醛化。
在人体肝细胞组织中,左乙拉西坦不产生酶诱导作用。因而,本品和其他物质共同应用,通常不产生相互作用。反之亦然。
消除
成人血浆半衰期: 7±1 小时,并不因给药剂量不同,给药途径不同或者重复给药而更改。平均体内总清除率为 0.96 ml/min/kg。
药物主要从尿液中排泄约为剂量的 95%(大约 93% 在 48 小时内排泄)。从粪便内排泄的药物仅仅占 0.3%。
在开始给药的 48 小时内,累计左乙拉西坦及其代谢产物的排泄率分别为给药剂量的 66% 和 24%。
左乙拉西坦和 UCBL057 肾脏清除率分别为 0.6 和 4.2 ml/min/kg,这表明左乙拉西坦通过肾小球滤过后经肾小管重吸收后排除,主要代谢产物也是通过肾小管分泌和肾小球滤过消除。左乙拉西坦的消除率和肌酐的清除率相关。
老年病人
老年患者左乙拉西坦的半衰期大约延长了 40%(10-11 小时)。这与肾脏功能下降有关。
儿童(4 到 12 岁)
单剂量给药(20 mg/kg),儿童左乙拉西坦的血浆半衰期为 6.0 小时(6-12 岁)。其表观清除率(体重调节后)约比癫痫成人高 30%。
儿童(4-12 岁)重复口服(20-60 mg/kg/日)后,左乙拉西坦迅速吸收。用药后 0.5-1 小时达峰浓度。峰浓度及曲线下面积呈线性,并与剂量成比例增加。清除半衰期为 5 小时,表观体内清除率约为 1.1 ml/min/kg。
婴儿和幼儿(1 个月到 4 岁)
单剂量给予 10%口服溶液量(20 mg/kg)后,儿童患者(1 个月到 4 岁)吸收迅速。给药 1 小时后,血药达峰。药代动力学数据显示其半衰期(5.3 小时)短于成人(7.2 小时),婴幼儿的表观体内清除率(1.5 ml/min/kg)快于成人(0.96 ml/min/kg)。
主要代谢产物 UCB L057 量,儿童低于成人。
肾功能损害患者
肾功能损害患者,其左乙拉西坦和主要代谢产物的体内清除率取决于肌酐的清除率。因此,中度或者重度肾功能不全的病人建议根据肌酐清除率调整每日维持剂量。
在肾病晚期无尿症病人中,由于进行透析间期和透析期内,成人药物的血浆半衰期分别为 25 和 3.1 小时。
在 4 小时的透析过程中,51% 左乙拉西坦被分级去除。
肝功能损害
在中轻度肝损的病人中,左乙拉西坦的清除率没有相应的变化。大部分严重肝功损害患者左乙拉西坦的清除率下降幅度大于 50%,其主要原因是合并肾功能受损。
【是否OTC】
否
【核准日期】
2006-11-22
【修改日期】
2020-07-01